 Silhouette
正德厚生,笃学敏行——南京师范大学
Silhouette
正德厚生,笃学敏行——南京师范大学
菁优网首页
spdfg的最新日志
2020年10月27日 15:42 | 阅读(1542) | 评论(0)电离能与电子亲和能
2020年10月于南京师范大学仙林校区,化学与材料科学学院.
参考教材:Mark Weller,Tina Overton,Jonathan Rourke,Fraser Armstrong.Inorganic Chemistry,7th edition.
Gary Miessler,Paul Fischer,Donald Tarr.Inorganic Chemistry,5th edition.
Catherine Housecroft,Alan Sharpe.Inorganic Chemistry,5th edition.
电离能(Ionization Energy)用以衡量原子失去电子容易程度,定义如下过程:
A(g)→A+(g)+e-(g) I=E(A+,g)-E(A,g),此为第一电离能,
以此类推,A+(g)→A2+(g)+e-(g) I=E(A2+,g)-E(A+,g),此为第二电离能,
……
诚然,由于静电引力,从一个正电荷体系再想移除一个电子,那自然是相当困难,正电荷越多,想移除电子就显得愈发困难,因此对于逐级电离能有一个明显的趋势:I1<I2<I3<…….
但需注意,在热力学计算中,往往比较适合拿来计算的是电离焓(ionization enthalpy),标准数值取于298K,一个热力学标准压力下,摩尔电离焓变与电离能的关系为△ionHm=I+2.5RT,这一部分偏差(2.5RT)来自于T=0到所取温度298K之间的热容项所得,以及电离前后气相摩尔数的变化,而RT项在室温下(298K)仅为2.5kJ/mol,而电离能的数量级达到102-103kJ/mol,因此这一项往往可以忽略,
证明:根据焓的定义式H=U+pV,取改变量:△H=△U+△(pV),恒压下,p可以取出得到△H=△U+p△V,而在通常情况下,p△V项相对于体系焓变来说可以忽略不计,即△H(T)≈△U(T),而在T=0时,I=△U=△H.
此处先考虑△U和△H存在差异,从T=0→T=298K的温度变化内,根据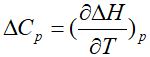 ,则△H(298K)-△H(0)=
,则△H(298K)-△H(0)=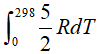 =2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.
=2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.
2019年11月17日 19:38 | 阅读(1592) | 评论(0)物理化学专题——相平衡之吉布斯相律的魅力
相平衡是物理化学中稍有难度的一门研究,然其重要的理论依据是吉布斯的相律(或者说是化学势的平衡),重要的研究工具便是相图,相图是严格符合相律的,而在考研物理化学中,相律题,部分难度还是不小的,稍不留神,相律就用错了.
相律的表达式:f=C-P+n,C为独立组分数,P为相数,n为系统的强度量(n通常为2,表示压强,温度)
之所以说独立组分数,是为了跟物种数S做区分,因每个人考虑物种数的角度不一样,所以S的价值不是很大,但是不管怎么考虑,系统的独立组分数C总是不变的,存在关系C=S-R-R',其中R为系统独立化学反应数目,同理,说独立是表明反应不能像利用盖斯定律求算那样使得系统中的不同反应之间存在线性关系,比如说①A+B→C,②B+D→E,③A+B+D→CE,这三个反应只有其中任意两个才称为独立反应(R=2),因为始终存在一条线性关系:①+②=③,至于R'则是不容易把握的一个量,说相律难也就难在确定R'这个量,他表示同一相中的浓度限制(有些教材写成∑xi=1,这并不构成一个浓度限制条件,因为你无论加多少物质,必然有各物种的物质的量分数之和为1,这个条件在推导相律表达式的时候已经扣掉了,不需要继续扣除),下面通过例题具体描述确定组分数C.
在标准压力下,无固体I2存在时,I2在水和CCl4中达到分配平衡,使用相律描述体系.
解:首先看到在标准压力下,则强度量之一的压强已经确定,即n=1,
无固体I2存在时,I2在水和CCl4中达到分配平衡,这是一个相平衡体系,可以使用相律,C=3(S=3,R=0,R'=0),P=2(两个相,一个是水相,一个是CCl4有机相),所以体系自由度f=C-P+n=3-2+1=2,说明还存在两个独立的变量,这两个独立变量确定,体系状态随之确定,这就是相律的“魅力”所在.
点评:很多物理化学初学者会认为,该体系独立独立组分数应为C=3-0-1=2(即S=3,R=0,R'=1),这当然是不对的,的确,达到分配平衡满足能斯特分配定律:I2在水相和有机相中的浓度比值是确定的(等于分配系数K),于是便认为这构成了浓度限制条件,可以有两点理由说明这种理解是错误的:①R'特指同一相中浓度限制,这里涉及到两个相;②分配平衡其实是I2在两相中达到化学势的一个平衡,即μ(I2,水)=μ(I2,CCl4),而这一条件是使用相律的必然条件,推导相律表达式时已经将这一条件扣除了,在R'中并不需要再扣掉一次,所以真正来说,这里浓度限制条件R'=0!
那么我们不妨回过头来想一下,我们已经算出了体系自由度为2,还有两个变量,是什么呢?一个是温度T,一个就是其中任何一相中的I2浓度,所以说就是两个变量.温度改变,影响分配平衡浓度改变,而只要确定其中一相中的I2浓度,另一相必然确定,严格符合相律!
25℃时,NaOH和H3PO4的水溶液达到平衡,使用相律描述体系.
方法一:有些人喜欢从化学反应角度考虑,即以离子态考虑,我们考查一下这个反应体系,首先主要存在NaOH,H3PO4,H2O,考虑体系存在反应:
①OH-+H3PO4═H2PO4-+H2O;
②OH-+H2PO4-═HPO42-+H2O;
③OH-+HPO42-═PO43-+H2O;
④H2O⇌H++OH-;
这样一来,物种数S=8(Na+,H+,OH-,H2O,H3PO4,H2PO4-,HPO42-,PO43-),R=4,R'=1(电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)),这样一来,C=S-R-R'=8-4-1=3,P=1,n=1(温度已经确定为25℃),所以体系自由度为:f=C-P+n=3-1+1=3,
方法二:按分子态考虑,体系存在独立组分为C=3(NaOH,H3PO4,H2O),惊叹!按分子态考虑如此简单,而且不易出错,所以一定要优先考虑分子态角度出发,因为即使发生反应,多生成一个物质,S多了1个,那必然在R中扣掉一个,净结果依然还是一样的.
Na+,Cl-,K+,NO3-,H2O(l)达到平衡的体系,使用相律描述该体系.
解:本题就必须要求会使用离子态考虑了,S=5(Na+,Cl-,K+,NO3-,H2O),R=0,R'=1(电荷守恒:c(Na+)+c(K+)=c(Cl-)+c(NO3-)),所以C=S-R-R'=5-0-1=4,P=1,n=2,所以f=C-P+n=4-1+2=5,
当然如果还要考虑化学反应H2O⇌H++OH-,则S=7(Na+,Cl-,K+,NO3-,H+,OH-,H2O),R=1(H2O⇌H++OH-),这时候R'=2(电荷守恒:c(Na+)+c(K+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),物料守恒:c(H+)=c(OH-)),则C=S-R-R'=7-1-2=4,独立组分数依然为4,可见无论怎么考虑,C总是一样的,这就是相律的“魅力”所在.
此外还有一些“抽象”上的浓度限制条件,也就是不容易判断出R'的情况.
恰好形成NaCl饱和溶液,没有固体析出的体系:S=2(NaCl,H2O),R=0,R'=1(这个R'=1是较难的点,大多数人看不出来,需要稍微思考一下,因为是恰好形成NaCl饱和溶液,没有固体析出的体系,则体系存在一个饱和浓度b(NaCl)=n(NaCl)/m(H2O),这个是可以确定的),所以C=1,不是2,确定R'=1是易错点.
二组分液态混合物形成恒沸点时的条件自由度(f*):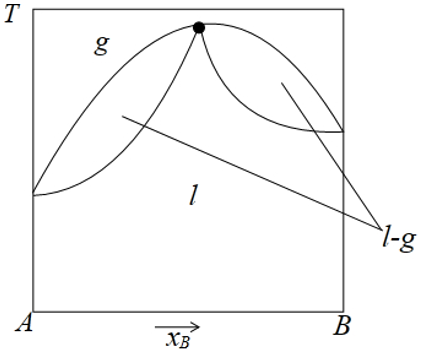 ,
,
g表示气相区,l表示液相区,l-g表示气液平衡两相区,这个相图就有最高恒沸点(黑点处),这里条件自由度f*=0,即C-P+1=0,P=2,C=1,明明是二组分(A+B),为什么独立组分数为1呢,这就是浓度限制R'=1在起作用,因为该点(xB=yB),这就是浓度限制,同样,这个R'=1,大部分看不出来,属于难点.
2019年09月30日 21:14 | 阅读(1568) | 评论(0)物理化学专题——化学热力学偏微分的计算题
物理化学中难度较大的题型就属热力学函数间偏微分的计算,考研的物理化学科目中,往往985/211名校在出题时会加入一些热力学函数间的偏微分运算,以此达到区分的目的,下面简要分享一些常见的题型.





2018年05月25日 09:16 | 阅读(1616) | 评论(0)物理化学中关于Mayer公式的推导
等容过程,系统不做体积功,当升高温度时,它从环境中吸收的热全部用来增加热力学能.但在等压过程中,升高温度时,系统除增加热力学能外,还要多吸收一部分热以对外作膨胀功.因此对于气体来说,Cp恒大于Cv.
对于任意系统,如何求算Cp与Cv之差呢?
首先根据定义式:${C}_{p}=(\frac{∂H}{∂T})_{p}$,${C}_{V}=(\frac{∂U}{∂T})_{V}$,
其次考虑到H=U+pV,
所以Cp-Cv=$(\frac{∂U}{∂T})_{p}+p(\frac{∂V}{∂T})_{p}-(\frac{∂U}{∂T})_{V}$,
注意到$(\frac{∂U}{∂T})_{p}$与$(\frac{∂U}{∂T})_{V}$二者是不相等的,存在一个关系式:
$(\frac{∂U}{∂T})_{p}=(\frac{∂U}{∂T})_{V}+(\frac{∂U}{∂V})_{T}(\frac{∂V}{∂T})_{p}$
所以最终得到一个普适公式:Cp-Cv=$[p+(\frac{∂U}{∂V})_{T}](\frac{∂V}{∂T})_{p}$,
而对于理想气体,考虑理想气体状态方程:pV=nRT,接下来推导则是两种思想,但是殊途同归:
①根据Gay-Lussac-Joule实验,得出$(\frac{∂U}{∂V})_{T}=0$,
于是Cp-Cv=$p(\frac{∂V}{∂T})_{p}$=nR,
②基于$(\frac{∂U}{∂V})_{p}$继续推导,借助热力学基本方程之一:dU=-pdV+TdS,
则有$(\frac{∂U}{∂V})_{T}=-p+(\frac{∂S}{∂V})_{T}$,
再根据Maxswell方程:$(\frac{∂S}{∂V})_{T}=(\frac{∂p}{∂T})_{V}$,
所以最终Cp-CV=nR.
2017年11月27日 19:40 | 阅读(1596) | 评论(0)大学化学部分试题解析
无机化学部分
北师大版无机化学(第四版)下册元素化学部分有一道试题,是关于电化学的,笔者发现网上对该题有不同解析,得出的答案当然是不相同的,有对的也有错误的,在此给出笔者的思路,供参考和交流.
题文:为了测定难溶盐Ag2S的溶度积,可做以下实验:装如下原电池,银片做电池的正极,插入0.1mol/L的AgNO3溶液中,并将H2S气体不断通入AgNO3溶液中至饱和.做电池负极的锌片插入0.1mol/L的ZnSO4溶液中,并将氨气不断通入ZnSO4溶液直至游离氨NH3的浓度达到0.1mol/L为止,再用盐桥连接.测得该电池电动势为0.852V.试求Ag2S的Ksp值.[已知φθ(Ag+/Ag)=0.80V,φθ(Zn2+/Zn)=-0.76V,饱和时c(H2S)=0.1mol/L;H2S的K1=8.9×10-8,K2=1.2×10-13;Kf(Zn(NH3)42+)=3.8×108)
分析:本题实际上是一道难题,出题者已经适当降低了难度,如告诉了饱和时H2S的浓度为0.1mol/L,这本该是一个考查知识点.本题意在考查电化学,可以发现在本题中对正负极采取了复杂的操作,使该题求算正负极电极电势时难度无形之中加大了不少,当然本题也是一道竞赛题,有一年国初时考过,正确运用能斯特方程求算正负极电极电势即可正确解题.
解答:根据题意,可以知道正极反应为:2Ag+H2S⇌Ag2S+2H+,
负极反应为:Zn2++4NH3⇌Zn(NH3)42+,
先求算负极电极电势 Zn2++4NH3⇌Zn(NH3)42+,
x 0.1 0.1
根据能斯特方程,φ(Zn2+/Zn)=φθ(Zn2+/Zn)+$\frac{0.0592}{2}lgc(Z{n}^{2+})$
=φθ(Zn2+/Zn)+$\frac{0.0592}{2}lg\frac{c[Zn(N{H}_{3})_{4}^{2+}]}{{c}^{4}(N{H}_{3}){•K}_{f}[Zn(N{H}_{3})_{4}^{2+}]}$
=-0.76+$\frac{0.0592}{2}lg\frac{0.1}{0.{1}^{4}×3.8×1{0}^{8}}$
=-0.925V
已知电动势为E=0.852V,因此正极的电极电势为φ(Ag+/Ag)=E+φ(Zn2+/Zn)=-0.073V,
根据能斯特方程,正极的电极电势为φ(Ag+/Ag)=φθ(Ag+/Ag)+0.0592lgc(Ag+)
可求得c(Ag+)=1.79×10-15mol/L,
再来看正极:2Ag+H2S⇌Ag2S+2H+,
c 0.1 0.1
则溶液中c(S2-)=$\frac{{K}_{1}•{K}_{2}•c({H}_{2}S)}{{c}^{2}({H}^{+})}$=1.068×10-19mol/L,
因此Ag2S的溶度积为Ksp=c2(Ag+)c(S2-)=3.4×10-49.
评价:本题求解难度较大,考查的知识点较多,包含能斯特方程的应用,配合物稳定常数的计算,整体以能斯特方程考查为主,网上很多错的地方就在于对正极反应进行计算时,平衡时溶液中c(H+)把握不准导致错误,很多都认为平衡时溶液中c(H+)=0.2mol/L,考虑的角度错了,整个反应是需要从Ag+几乎所剩无几来考虑平衡时c(H+)的,因此是0.1mol/L,需要注意,这也是最大的一个易错点和难点.
物理化学部分
物理化学可以说是四大基础化学中难度最大的一门,涉及到的分支很多,这里就物化题中比较难的一类状态函数题解析.
南京大学版物理化学第五版中有一道课后习题,比较具有代表性.
题文:若令膨胀系数α=$\frac{1}{V}(\frac{∂V}{∂T})_{p}$,压缩系数$κ=-\frac{1}{V}(\frac{∂V}{∂p})_{T}$,
请证明:Cp-CV=$\frac{VT{α}^{2}}{κ}$,
分析:本题难度不小,首先看需要证明的公式,等式左边是两个热容之差,恒压热容Cp和恒容热容CV,需要明确知道二者定义式,然后借助麦克斯韦关系式和热力学基本方程推导.
证明:根据定义式,${C}_{p}=(\frac{∂H}{∂T})_{p}$,${C}_{V}=(\frac{∂U}{∂T})_{V}$,
则Cp-CV=$(\frac{∂H}{∂T})_{p}-(\frac{∂U}{∂T})_{V}$
考虑到H=U+pV
代入可得Cp-CV=$(\frac{∂U}{∂T})_{p}-(\frac{∂U}{∂T})_{V}+p(\frac{∂V}{∂T})_{p}$
需要注意这里的易错点,$(\frac{∂U}{∂T})_{p}≠(\frac{∂U}{∂T})_{V}$,
但是二者仍具有换算关系,即$(\frac{∂U}{∂T})_{p}=(\frac{∂U}{∂T})_{V}+(\frac{∂U}{∂V})_{T}(\frac{∂V}{∂T})_{p}$,
代入可得Cp-CV=$({\frac{∂U}{∂V})}_{T}({\frac{∂V}{∂T})}_{p}+p(\frac{∂V}{∂T})_{p}$
根据热力学基本方程,dU=-pdV+TdS,
因此$(\frac{∂U}{∂V})_{T}=-p+T(\frac{∂S}{∂V})_{T}$,
又由麦克斯韦方程,$(\frac{∂S}{∂V})_{T}=(\frac{∂p}{∂T})_{V}$,
因此原式可以化简为${C}_{p}-{C}_{V}=T(\frac{∂p}{∂T})_{V}(\frac{∂V}{∂T})_{p}$,
这个时候需要回归题目条件,题中给出的是V和T、p的关系,我们化简出的表达式中还有p和T、V的关系,需要把这部分化成V和T的关系,由此我们又想到还有一个循环偏微分的关系,是围绕理想气体状态方程展开的,
即$(\frac{∂p}{∂T})_{V}•(\frac{∂T}{∂V})_{p}•(\frac{∂V}{∂p})_{T}=-1$,
继续代入则化简出来得到${C}_{p}-{C}_{V}=-T•\frac{1}{(\frac{∂T}{∂V})_{p}•(\frac{∂V}{∂p})_{T}}•(\frac{∂V}{∂T})_{p}$
最终经过整理可以得到${C}_{p}-{C}_{V}=TV•\frac{\frac{1}{{V}^{2}}[(\frac{∂V}{∂T})_{p}]^{2}}{(-\frac{1}{V})(\frac{∂V}{∂p})_{T}}=\frac{VT{α}^{2}}{κ}$,证明完毕.
评论;本题难度比较大,硬性要求学生有高等数学的能力,以及掌握热力学基本方程和麦克斯韦方程的知识,同时还要灵活运用定义式化简,做出来不易,其中化简过程中的另一个难点就是关于角标转化公式的运用,当然题目出的是很好,具有一定的区分度.
2017年11月26日 18:28 | 阅读(1611) | 评论(0)大学无机化学中元素推断题解析
重点解析部分大学无机化学元素推断题,思路由笔者提供,供参考与交流.
元素化学一直是无机化学中的一个重点和难点,也是无机合成化学与无机材料化学研究的基础,在无机化学中占有重要的地位,作为大学基础化学无机化学中的元素化学,还是以基础为主.
参考书目:①北京师范大学,华中师范大学,南京师范大学三校无机化学教研室合编 无机化学(第四版)吴国庆主编;
②吉林大学,武汉大学,南开大学三校合编 无机化学(第三版) 宋天佑主编.
以下引用时称①为北师大版,②为吉大版.
吉大版第13章硼族元素习题13-8(1)
题文:单质(A)为棕色粉末,在空气中燃烧生成物质(B),(B)溶于水生成(C)的溶液,该溶液显弱酸性.将化合物(D)溶于水,并用H2SO4调节酸度,可析出(C)晶体.(A)的氯化物(E)水解强烈,并产生(C)和刺激性气体(F).(D)受热到400℃左右,将失去约47%的质量,转成物质(G).
试给出(A),(B),(C),(D),(E),(F)和(G)所代表的物质的化学式,并用化学反应方程式表示各过程.
分析:本题考查硼族元素性质,突破口为化合物(D)溶于水用硫酸调节酸度可以析出晶体,这是典型的硼砂的性质,因此可确定本题的主元素为B,寻找到了突破口,可以很容易知道A为B,在空气中燃烧生成B,B为B2O3,B2O3溶于水可以生成硼酸,硼酸是一元弱酸,C为H3BO3,D为硼砂,但是此时确定硼砂的化学却是一个难点,需要从受热失去47%左右的质量考虑,最终应该确定下来D为Na2B4O7•10H2O,失去所有结晶水符合题意,则G为Na2B4O7,A的氯化物为BCl3,水解强烈产生C和刺激性气体F,这边很容易,C为H3BO3,F为HCl,这样所有物质均已推断得出.
解答:A:B;B:B2O3;C:H3BO3;D:Na2B4O7•10H2O;E:BCl3;F:HCl;G:Na2B4O7,
方程式不成问题,此处就不加赘述.
评论:本题对于B的相关化合物的性质考查的比较全面,并同时考查了关于硼砂分子式的掌握,硼砂分子式可以写成Na2B4O7•10H2O或者Na2B4O5(OH)4•8H2O.事实上关于硼的元素化学性质还有很多,本题考查了BCl3的水解,若考查的是BF3水解则又是一个易错点,因此BF3水解产物是HBF4和H3BO3,而不是单纯的HF和H3BO3.
另外,需要记住,硼酸H3BO3是一元弱酸,且是Lewis酸,它电离不是按质子酸电离自身产生H+,而是接受水中的OH-,继而产生H+,既然是一元酸,就只应该有一级酸常数,笔者注意到国内某知名大学编写的无机化学教材中竟给出了三级电离常数,这是一个严重的错误,三级电离常数的给出是100多年前的理论计算值,后来已经证实了硼酸是一元酸,不应犯此错误.
个人资料
-
spdfg
-
- 等级:
- 下载次数:0
- 性别:男
- 生日:1998年3月9日
- 地区:江苏省南京市玄武区
- 年级:高三
©2010-2024 jyeoo.com 版权所有 |粤ICP备10006842号| 站长统计