 Silhouette
正德厚生,笃学敏行——南京师范大学
Silhouette
正德厚生,笃学敏行——南京师范大学
菁优网首页
2020年10月27日 15:42 | 阅读(2792) | 评论(0)电离能与电子亲和能
2020年10月于南京师范大学仙林校区,化学与材料科学学院.
参考教材:Mark Weller,Tina Overton,Jonathan Rourke,Fraser Armstrong.Inorganic Chemistry,7th edition.
Gary Miessler,Paul Fischer,Donald Tarr.Inorganic Chemistry,5th edition.
Catherine Housecroft,Alan Sharpe.Inorganic Chemistry,5th edition.
电离能(Ionization Energy)用以衡量原子失去电子容易程度,定义如下过程:
A(g)→A+(g)+e-(g) I=E(A+,g)-E(A,g),此为第一电离能,
以此类推,A+(g)→A2+(g)+e-(g) I=E(A2+,g)-E(A+,g),此为第二电离能,
……
诚然,由于静电引力,从一个正电荷体系再想移除一个电子,那自然是相当困难,正电荷越多,想移除电子就显得愈发困难,因此对于逐级电离能有一个明显的趋势:I1<I2<I3<…….
但需注意,在热力学计算中,往往比较适合拿来计算的是电离焓(ionization enthalpy),标准数值取于298K,一个热力学标准压力下,摩尔电离焓变与电离能的关系为△ionHm=I+2.5RT,这一部分偏差(2.5RT)来自于T=0到所取温度298K之间的热容项所得,以及电离前后气相摩尔数的变化,而RT项在室温下(298K)仅为2.5kJ/mol,而电离能的数量级达到102-103kJ/mol,因此这一项往往可以忽略,
证明:根据焓的定义式H=U+pV,取改变量:△H=△U+△(pV),恒压下,p可以取出得到△H=△U+p△V,而在通常情况下,p△V项相对于体系焓变来说可以忽略不计,即△H(T)≈△U(T),而在T=0时,I=△U=△H.
此处先考虑△U和△H存在差异,从T=0→T=298K的温度变化内,根据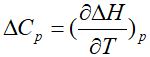 ,则△H(298K)-△H(0)=
,则△H(298K)-△H(0)=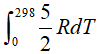 =2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.
=2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.
参考教材:Mark Weller,Tina Overton,Jonathan Rourke,Fraser Armstrong.Inorganic Chemistry,7th edition.
Gary Miessler,Paul Fischer,Donald Tarr.Inorganic Chemistry,5th edition.
Catherine Housecroft,Alan Sharpe.Inorganic Chemistry,5th edition.
电离能(Ionization Energy)用以衡量原子失去电子容易程度,定义如下过程:
A(g)→A+(g)+e-(g) I=E(A+,g)-E(A,g),此为第一电离能,
以此类推,A+(g)→A2+(g)+e-(g) I=E(A2+,g)-E(A+,g),此为第二电离能,
……
诚然,由于静电引力,从一个正电荷体系再想移除一个电子,那自然是相当困难,正电荷越多,想移除电子就显得愈发困难,因此对于逐级电离能有一个明显的趋势:I1<I2<I3<…….
但需注意,在热力学计算中,往往比较适合拿来计算的是电离焓(ionization enthalpy),标准数值取于298K,一个热力学标准压力下,摩尔电离焓变与电离能的关系为△ionHm=I+2.5RT,这一部分偏差(2.5RT)来自于T=0到所取温度298K之间的热容项所得,以及电离前后气相摩尔数的变化,而RT项在室温下(298K)仅为2.5kJ/mol,而电离能的数量级达到102-103kJ/mol,因此这一项往往可以忽略,
证明:根据焓的定义式H=U+pV,取改变量:△H=△U+△(pV),恒压下,p可以取出得到△H=△U+p△V,而在通常情况下,p△V项相对于体系焓变来说可以忽略不计,即△H(T)≈△U(T),而在T=0时,I=△U=△H.
此处先考虑△U和△H存在差异,从T=0→T=298K的温度变化内,根据
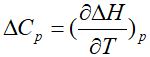 ,则△H(298K)-△H(0)=
,则△H(298K)-△H(0)=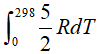 =2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.
=2.5×8.134J/(mol•K)×298K=6.2kJ/mol,这一项相对于电离能数值来说实在太小,因此可以忽略,也就说明△ionHm≈I,直接将I用于热力学循环计算是可行的.- 评论
- 评论内容
个人资料
-
spdfg
©2010-2026 jyeoo.com 版权所有 |粤ICP备10006842号