 Silhouette
正德厚生,笃学敏行——南京师范大学
Silhouette
正德厚生,笃学敏行——南京师范大学
菁优网首页
2019年11月17日 19:38 | 阅读(2966) | 评论(0)物理化学专题——相平衡之吉布斯相律的魅力
相平衡是物理化学中稍有难度的一门研究,然其重要的理论依据是吉布斯的相律(或者说是化学势的平衡),重要的研究工具便是相图,相图是严格符合相律的,而在考研物理化学中,相律题,部分难度还是不小的,稍不留神,相律就用错了.
相律的表达式:f=C-P+n,C为独立组分数,P为相数,n为系统的强度量(n通常为2,表示压强,温度)
之所以说独立组分数,是为了跟物种数S做区分,因每个人考虑物种数的角度不一样,所以S的价值不是很大,但是不管怎么考虑,系统的独立组分数C总是不变的,存在关系C=S-R-R',其中R为系统独立化学反应数目,同理,说独立是表明反应不能像利用盖斯定律求算那样使得系统中的不同反应之间存在线性关系,比如说①A+B→C,②B+D→E,③A+B+D→CE,这三个反应只有其中任意两个才称为独立反应(R=2),因为始终存在一条线性关系:①+②=③,至于R'则是不容易把握的一个量,说相律难也就难在确定R'这个量,他表示同一相中的浓度限制(有些教材写成∑xi=1,这并不构成一个浓度限制条件,因为你无论加多少物质,必然有各物种的物质的量分数之和为1,这个条件在推导相律表达式的时候已经扣掉了,不需要继续扣除),下面通过例题具体描述确定组分数C.
在标准压力下,无固体I2存在时,I2在水和CCl4中达到分配平衡,使用相律描述体系.
解:首先看到在标准压力下,则强度量之一的压强已经确定,即n=1,
无固体I2存在时,I2在水和CCl4中达到分配平衡,这是一个相平衡体系,可以使用相律,C=3(S=3,R=0,R'=0),P=2(两个相,一个是水相,一个是CCl4有机相),所以体系自由度f=C-P+n=3-2+1=2,说明还存在两个独立的变量,这两个独立变量确定,体系状态随之确定,这就是相律的“魅力”所在.
点评:很多物理化学初学者会认为,该体系独立独立组分数应为C=3-0-1=2(即S=3,R=0,R'=1),这当然是不对的,的确,达到分配平衡满足能斯特分配定律:I2在水相和有机相中的浓度比值是确定的(等于分配系数K),于是便认为这构成了浓度限制条件,可以有两点理由说明这种理解是错误的:①R'特指同一相中浓度限制,这里涉及到两个相;②分配平衡其实是I2在两相中达到化学势的一个平衡,即μ(I2,水)=μ(I2,CCl4),而这一条件是使用相律的必然条件,推导相律表达式时已经将这一条件扣除了,在R'中并不需要再扣掉一次,所以真正来说,这里浓度限制条件R'=0!
那么我们不妨回过头来想一下,我们已经算出了体系自由度为2,还有两个变量,是什么呢?一个是温度T,一个就是其中任何一相中的I2浓度,所以说就是两个变量.温度改变,影响分配平衡浓度改变,而只要确定其中一相中的I2浓度,另一相必然确定,严格符合相律!
25℃时,NaOH和H3PO4的水溶液达到平衡,使用相律描述体系.
方法一:有些人喜欢从化学反应角度考虑,即以离子态考虑,我们考查一下这个反应体系,首先主要存在NaOH,H3PO4,H2O,考虑体系存在反应:
①OH-+H3PO4═H2PO4-+H2O;
②OH-+H2PO4-═HPO42-+H2O;
③OH-+HPO42-═PO43-+H2O;
④H2O⇌H++OH-;
这样一来,物种数S=8(Na+,H+,OH-,H2O,H3PO4,H2PO4-,HPO42-,PO43-),R=4,R'=1(电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)),这样一来,C=S-R-R'=8-4-1=3,P=1,n=1(温度已经确定为25℃),所以体系自由度为:f=C-P+n=3-1+1=3,
方法二:按分子态考虑,体系存在独立组分为C=3(NaOH,H3PO4,H2O),惊叹!按分子态考虑如此简单,而且不易出错,所以一定要优先考虑分子态角度出发,因为即使发生反应,多生成一个物质,S多了1个,那必然在R中扣掉一个,净结果依然还是一样的.
Na+,Cl-,K+,NO3-,H2O(l)达到平衡的体系,使用相律描述该体系.
解:本题就必须要求会使用离子态考虑了,S=5(Na+,Cl-,K+,NO3-,H2O),R=0,R'=1(电荷守恒:c(Na+)+c(K+)=c(Cl-)+c(NO3-)),所以C=S-R-R'=5-0-1=4,P=1,n=2,所以f=C-P+n=4-1+2=5,
当然如果还要考虑化学反应H2O⇌H++OH-,则S=7(Na+,Cl-,K+,NO3-,H+,OH-,H2O),R=1(H2O⇌H++OH-),这时候R'=2(电荷守恒:c(Na+)+c(K+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),物料守恒:c(H+)=c(OH-)),则C=S-R-R'=7-1-2=4,独立组分数依然为4,可见无论怎么考虑,C总是一样的,这就是相律的“魅力”所在.
此外还有一些“抽象”上的浓度限制条件,也就是不容易判断出R'的情况.
恰好形成NaCl饱和溶液,没有固体析出的体系:S=2(NaCl,H2O),R=0,R'=1(这个R'=1是较难的点,大多数人看不出来,需要稍微思考一下,因为是恰好形成NaCl饱和溶液,没有固体析出的体系,则体系存在一个饱和浓度b(NaCl)=n(NaCl)/m(H2O),这个是可以确定的),所以C=1,不是2,确定R'=1是易错点.
二组分液态混合物形成恒沸点时的条件自由度(f*):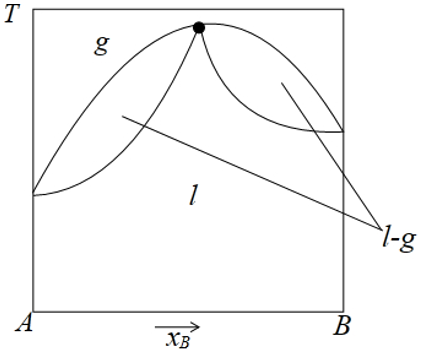 ,
,
g表示气相区,l表示液相区,l-g表示气液平衡两相区,这个相图就有最高恒沸点(黑点处),这里条件自由度f*=0,即C-P+1=0,P=2,C=1,明明是二组分(A+B),为什么独立组分数为1呢,这就是浓度限制R'=1在起作用,因为该点(xB=yB),这就是浓度限制,同样,这个R'=1,大部分看不出来,属于难点.
相律的表达式:f=C-P+n,C为独立组分数,P为相数,n为系统的强度量(n通常为2,表示压强,温度)
之所以说独立组分数,是为了跟物种数S做区分,因每个人考虑物种数的角度不一样,所以S的价值不是很大,但是不管怎么考虑,系统的独立组分数C总是不变的,存在关系C=S-R-R',其中R为系统独立化学反应数目,同理,说独立是表明反应不能像利用盖斯定律求算那样使得系统中的不同反应之间存在线性关系,比如说①A+B→C,②B+D→E,③A+B+D→CE,这三个反应只有其中任意两个才称为独立反应(R=2),因为始终存在一条线性关系:①+②=③,至于R'则是不容易把握的一个量,说相律难也就难在确定R'这个量,他表示同一相中的浓度限制(有些教材写成∑xi=1,这并不构成一个浓度限制条件,因为你无论加多少物质,必然有各物种的物质的量分数之和为1,这个条件在推导相律表达式的时候已经扣掉了,不需要继续扣除),下面通过例题具体描述确定组分数C.
在标准压力下,无固体I2存在时,I2在水和CCl4中达到分配平衡,使用相律描述体系.
解:首先看到在标准压力下,则强度量之一的压强已经确定,即n=1,
无固体I2存在时,I2在水和CCl4中达到分配平衡,这是一个相平衡体系,可以使用相律,C=3(S=3,R=0,R'=0),P=2(两个相,一个是水相,一个是CCl4有机相),所以体系自由度f=C-P+n=3-2+1=2,说明还存在两个独立的变量,这两个独立变量确定,体系状态随之确定,这就是相律的“魅力”所在.
点评:很多物理化学初学者会认为,该体系独立独立组分数应为C=3-0-1=2(即S=3,R=0,R'=1),这当然是不对的,的确,达到分配平衡满足能斯特分配定律:I2在水相和有机相中的浓度比值是确定的(等于分配系数K),于是便认为这构成了浓度限制条件,可以有两点理由说明这种理解是错误的:①R'特指同一相中浓度限制,这里涉及到两个相;②分配平衡其实是I2在两相中达到化学势的一个平衡,即μ(I2,水)=μ(I2,CCl4),而这一条件是使用相律的必然条件,推导相律表达式时已经将这一条件扣除了,在R'中并不需要再扣掉一次,所以真正来说,这里浓度限制条件R'=0!
那么我们不妨回过头来想一下,我们已经算出了体系自由度为2,还有两个变量,是什么呢?一个是温度T,一个就是其中任何一相中的I2浓度,所以说就是两个变量.温度改变,影响分配平衡浓度改变,而只要确定其中一相中的I2浓度,另一相必然确定,严格符合相律!
25℃时,NaOH和H3PO4的水溶液达到平衡,使用相律描述体系.
方法一:有些人喜欢从化学反应角度考虑,即以离子态考虑,我们考查一下这个反应体系,首先主要存在NaOH,H3PO4,H2O,考虑体系存在反应:
①OH-+H3PO4═H2PO4-+H2O;
②OH-+H2PO4-═HPO42-+H2O;
③OH-+HPO42-═PO43-+H2O;
④H2O⇌H++OH-;
这样一来,物种数S=8(Na+,H+,OH-,H2O,H3PO4,H2PO4-,HPO42-,PO43-),R=4,R'=1(电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)),这样一来,C=S-R-R'=8-4-1=3,P=1,n=1(温度已经确定为25℃),所以体系自由度为:f=C-P+n=3-1+1=3,
方法二:按分子态考虑,体系存在独立组分为C=3(NaOH,H3PO4,H2O),惊叹!按分子态考虑如此简单,而且不易出错,所以一定要优先考虑分子态角度出发,因为即使发生反应,多生成一个物质,S多了1个,那必然在R中扣掉一个,净结果依然还是一样的.
Na+,Cl-,K+,NO3-,H2O(l)达到平衡的体系,使用相律描述该体系.
解:本题就必须要求会使用离子态考虑了,S=5(Na+,Cl-,K+,NO3-,H2O),R=0,R'=1(电荷守恒:c(Na+)+c(K+)=c(Cl-)+c(NO3-)),所以C=S-R-R'=5-0-1=4,P=1,n=2,所以f=C-P+n=4-1+2=5,
当然如果还要考虑化学反应H2O⇌H++OH-,则S=7(Na+,Cl-,K+,NO3-,H+,OH-,H2O),R=1(H2O⇌H++OH-),这时候R'=2(电荷守恒:c(Na+)+c(K+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),物料守恒:c(H+)=c(OH-)),则C=S-R-R'=7-1-2=4,独立组分数依然为4,可见无论怎么考虑,C总是一样的,这就是相律的“魅力”所在.
此外还有一些“抽象”上的浓度限制条件,也就是不容易判断出R'的情况.
恰好形成NaCl饱和溶液,没有固体析出的体系:S=2(NaCl,H2O),R=0,R'=1(这个R'=1是较难的点,大多数人看不出来,需要稍微思考一下,因为是恰好形成NaCl饱和溶液,没有固体析出的体系,则体系存在一个饱和浓度b(NaCl)=n(NaCl)/m(H2O),这个是可以确定的),所以C=1,不是2,确定R'=1是易错点.
二组分液态混合物形成恒沸点时的条件自由度(f*):
 ,
,g表示气相区,l表示液相区,l-g表示气液平衡两相区,这个相图就有最高恒沸点(黑点处),这里条件自由度f*=0,即C-P+1=0,P=2,C=1,明明是二组分(A+B),为什么独立组分数为1呢,这就是浓度限制R'=1在起作用,因为该点(xB=yB),这就是浓度限制,同样,这个R'=1,大部分看不出来,属于难点.
- 评论
- 评论内容
个人资料
-
spdfg
©2010-2026 jyeoo.com 版权所有 |粤ICP备10006842号